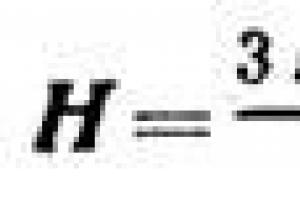Текущая страница: 7 (всего у книги 19 страниц) [доступный отрывок для чтения: 13 страниц]
Шрифт:
100% +
40. Обобщенное уравнение теории Дубинина объемного заполнения микропор, частные случаи этого уравнения
Поры, в отличие от молекул, взаимодействуют друг с другом, что подобно образованию полимолекулярного слоя, также множество молекул пор находится в контакте со стенами пор. В микропорах происходит объемное заполнение адсорбционного пространства, поэтому была принята за основной параметр пористого адсорбента не сама поверхность, а объем пор. В них может происходить перекрытие полей поверхностных сил, противоположных стене пор, что значительно повышает энергию адсорбции. Такой эффект наблюдается при исследовании адсорбции вещества некоторыми пористыми адсорбентами одного вида, но имеющего разные размеры пор. Если размеры пор сопоставимы, то происходит резкое увеличение процесса адсорбции в области малых равновесных давлений. В более крупных пористых материалах такой тип взаимодействия характерен только для первого слоя. В следующих слоях это взаимодействие не зависит от природы адсорбента, а может определяться только природой адсорбата. Еще у микропор проявляется силовой эффект, который заключается в адсорбировании молекул, размеры которых меньше размеров микропор или соизмеримы с ними. Степень заполнения адсорбента представляют как отношение величины адсорбции А к максимальной адсорбции А 0 , или как отношение заполненного объема V к предельному пространственному адсорбированному объему V 0 , которые приведены к нормальным условиям (давление и температура). Тогда получим:
V = V 0 exp[– (ε /β E 0) n ].
Для работы:
A = A 0 exp[– (ε /β E 0) n ],
где величина Е представляет собой энергию адсорбции, которая характерна для стандартного адсорбата.
Эти уравнения являются общими уравнениями теории объемного заполнения микропор. Прологарифмируем уравнение:
lnA = lnA 0 – (1 / β n E 0 n)ε n .
Величина Е называется характеристической энергией адсорбции. Отношение этих характеристических энергий для двух типов адсорбатов равно коэффициенту аффинности. Показатель степени n может быть определен только целыми числами и равен от 1 до 6 в зависимости от природы адсорбента. Строят прямую в координатах, которая дает возможность определить все изотермы адсорбции данного адсорбата при разных температурах, а коэффициенты аффинности – рассчитать зависимости для других видов адсорбата. Для многих активных углей справедливо
lnA = lnA 0 – B /T 2 / β 2 2 ,
где параметр В – const , характеризующая энергию адсорбции.
В этом случае коэффициент аффинности для активных углей может быть приблизительно равен отношению парахоров рассматриваемого вещества и стандартного. Парахор не зависит от температуры, поэтому этой величиной пользуются для определения характеристики адсорбатов. Тогда для крупнопористых активных углей справедливо следующее уравнение, причем здесь учитывается что n = 1:
lnA = lnA 0 – B /T / β ,
где В характеризует энергию адсорбции на крупнопористом материале.
Последние уравнения похожи на уравнение Фрейндлиха, в котором показатель степени при давлении может быть равен выражению перед логарифмом отношения давлений. И уравнение Фрейндлиха является частным случаем общего уравнения, которое характерно для полученной изотермы адсорбции, оно приведено в теории объемного заполнения микропор.
41. Адсорбция газов и паров на пористых материалах
Пористыми телами называют твердые тела, внутри которых имеются определенные поры, которые способны обусловливать наличие внутренней межфазной поверхности. Поры такого вида могут быть заполнены газом или жидкостью. Многие пористые системы можно представить как более или менее жесткие пространственные структуры, которые получили название «сетки» (или «каркасы»). Пористые тела могут быть также очень хрупкими, но в то же время обладать эластическими свойствами.
Пористые материалы обладают сильно различающейся адсорбционной способностью по отношению к влаге. В качестве адсорбентов, которые используются для извлечения, применяют специально получаемые пористые материалы, такие виды материалов также должны обладать прочностью и избирательностью. Высокодисперсные пористые материалы получают двумя методами.
Первый метод заключается в синтезе гидрозоля с последующим его осаждением до геля, полученный гель потом сушат. Адсорбенты корпускулярной структуры получают, получаемый высокопористый материал дробят, гранулируют или таблетируют. Примерами таких адсорбентов являются силикагели, алюмогели, окись магния. Существует второй метод , основанный на обработке крупнопористых материалов агрессивными газами или жидкостями. Такой тип обработки характерен для получения пористых материалов, имеющих губчатую природу, метод получения углей. Также пористые материалы можно разделить по группам.
1. Макропористые материалы. Имеют очень крупные поры – до нескольких сот нанометров. В адсорбентах и катализаторах такими порами можно пренебречь, т. к. они играют роль всего лишь транспортных каналов.
2. Переходно-пористые материалы. Небольшого размера поры – от десятка нанометров до сотни. Примерами материалов с такими порами являются силикагели, алюмогели, силикагели на основе алюминия.
3. Микропористые материалы. Размеры пор составляют несколько десятых долей нанометров к микропористым телам относятся цеолиты и некоторые активированные угли. Многие промышленные адсорбенты таких типов характеризуются широкой полидисперсностью и могут относиться к смешанным типам всех представленных типов адсорбентов. Полидисперсность таких материалов может быть определена распределением пор по размерам.
Количественные характеристики пористых материалов: одной из самых важных характеристик является пористость – отношение объема пор V п к общему объему всего тела V п:
П = V п / V п,
Пористость способна определять объем пор, который приходится на единицу объема всего тела, т. е. определяет долю всех пустот в его структуре. Может быть либо безразмерной величиной, либо измеряться в процентах. Если пористое тело имеет корпускулярную структуру, то для таких структур применяют удельную поверхность :
S уд = 3 / rρ ,
где r – радиус; ρ – плотность.
Исходя из этой величины можно определить удельную поверхность, зная фактически только радиус частиц, из которых образован материал. Также к пористым материалам применима величина «общая пористость», которая складывается из трех составляющих: пористостей открытых, закрытых, тупиковых пор в единице объема всего пористого тела.
Значит, с увеличением общей поверхности число пор как закрытого, так и тупикового характера уменьшается. И очевидно, что при адсорбции закрытые типы пор не участвуют в процессе.
42. Органические поверхностно-активные вещества (ПАВ). Классификация ПАВ
Поверхностно-активными веществами относительно воды являются многие органические соединения, а именно жирные кислоты, соли жирных кислот, спирты, амины, как ароматические, так и алифатические. Характерной особенностью поверхностно-активных веществ является их дифильность, т. е. строение молекулы из двух частей: полярной группы и неполярного углеводородного радикала. Все поверхностно-активные вещества можно разделить на три большие группы в соответствии с особенностями их строения:
1. Анионные поверхностно-активные вещества диссоциируют в воде, образуя отрицательно заряженные поверхностно-активные ионы. Важнейшими представителями этой группы являются обычные мыла и соли сульфокислот. Обычные мыла состоят из солей предельных и некоторых непредельных карбоновых кислот (С 15 Н 31 СООNa – пальмитат натрия, эту соль используют для технических целей, выделяя из животных жиров). Меньшее значение имеют калиевые и аммонийные мыла этих же кислот, жидкие в обычных условиях. Обычное мыло, имеющееся в продаже, содержит большое количество воды, а часто и примеси различных веществ, особенно электролитов, о чем следует помнить при его использовании.
2. Катионные поверхностно-активные вещества диссоциируют в воде, образуя положительно заряженные поверхностно-активные ионы. Из растворов этих поверхностно-активных веществ на поверхности адсорбируются катионы, и поверхности становится положительно заряженной. Например, С 18 Н 37 NH 3 Cl – октадециламмонийхлорид. Одновременное присутствие в водном растворе анионных и катионных поверхностно-активных веществ обычно не представляется возможным, т. к. в таком растворе из большого числа катионов и анионов образуется весьма слабодиссоциируемая соль, практически нерастворимая в воде. В качестве поверхностно-активных веществ в последнее время широко применяют и алкилсульфаты.
Неионогенные поверхностно-активные вещества , молекулы которых не способны к диссоциации. Дифильные части таких поверхностно-активных веществ обычно состоят из длинной углеводородной цепочки с небольшим количеством полярных, но неионогенных групп на конце молекулы, которая обусловливает растворимость этих веществ. Например, оксиэтилированные поверхностно-активные вещества, преимущество которых выражается в возможности при их получении регулировать гидрофильность молекулы путем изменения числа атомов углерода гидрофобной части цепи и числа оксиэтиленовых групп (С n H 2n+1 (OCH 2 CH 2) m OH). Благодаря этому можно получать вещества с заранее выбранными свойствами, рассчитанными на конкретную область применения, эти вещества также не образуют солей и поэтому хорошо растворяются в жесткой воде. Адсорбция неионогенных поверхностно-активных веществ из водных растворов превращает гидрофобные поверхности в гидрофильные. Важной характеристикой поверхностно-активного вещества является гидрофильно-липофильный баланс (ГЛБ) . Числа ГЛБ могут быть вычислены по специальным формулам как сумма групповых чисел или определены опытным путем. В качестве первого приближения используют теорию Гриффина , которая была развита Дэвисом . Она позволяет с энергетических позиций количественно оценить и выразить в виде условных групповых чисел степень, с которой взаимодействуют с водой отдельные группы частиц, из которых состоят поверхностно-активные вещества. Групповые числа для гидрофильных групп положительны, а липофильных – отрицательны. Чем больше баланс сдвинут в сторону гидрофильности, тем выше число ГЛБ.
Числа ГЛБ определяют области применения поверхностно-активных веществ.
43. Области применения ПАВ. Проблема биоразлагаемости ПАВ
Поверхностно-активные вещества имеют огромное практическое применение. Нет ни одной отрасли хозяйства, где бы ни использовали мыла, мылоподобные вещества. Ценные свойства поверхностно-активных веществ обусловлены образованием в растворе мицелл с высокой поверхностной активностью, короче говоря, способностью образовывать поверхностно-адсорбированные слои.
Также широко поверхностно-активные вещества используются для улучшения смачивания различных поверхностей водой, для получения стойких эмульсий и пен, а также для процессов флотации. Основное практическое применение поверхностно-активных веществ – это мыла. Известно, что твердые или жидкие загрязнения удаляются с поверхности волокон чистой водой с очень большими усилиями, даже при повышенной температуре и при интенсивном механическом воздействии. Важно отметить, что этот процесс пойдет легче, если для уборки используют раствор поверхностно-активного вещества. Моющее действие таких поверхностно-активных веществ связано с рядом различных эффектов.
1. В присутствии в воде поверхностно-активного вещества понижается поверхностное натяжение раствора, тем самым улучшается смачивание ткани моющей жидкостью. Это способствует проникновению жидкости в тонкие капилляры грязной ткани, в которые чистая вода проникнуть не может.
2. Молекулы мыла адсорбируются на поверхности волокна и частицах твердых или жидких загрязнений, что способствует отрыву грязевых частиц и их удалению.
3. Адсорбированные пленки на поверхности частиц загрязнений придают им достаточно высокую агрегативную устойчивость и предупреждают их прилипание в другом месте.
4. В присутствии поверхностно-активных веществ в моющей жидкости образуется пена, которая содействует механическому уносу загрязнений или флотации тех загрязнений, частицы которых вследствие пониженной способности к смачиванию прилипают к пузырькам воздуха.
Свойства поверхностно-активных веществ п роявляют почти все вещества, носящие дубящий характер, которые являются производными многоатомных фенолов, которые используются при дублении кожи. К красителям, проявляющим в растворах все особенности, свойственные растворам поверхностно-активных веществ, можно отнести ряд синтетических соединений-красителей.
Растворы таких красителей сходны с растворами высокомолекулярных соединений, они могут обладать сравнительно высокой агрегативной устойчивостью, а образующийся осадок при введении какого-либо электролита способен диспергироваться в чистой воде. Также поверхностно-активные вещества оказывают стабилизирующее действие на межфазную поверхность. Это определяется высокой поверхностной активностью вещества, т. к. концентрация поверхностно-активного вещества в десятки тысяч раз превышает объемную концентрацию.
Для неионогенных поверхностно-активных веществ вопрос о стабилизации дисперсных систем не рассматривается, и это является одной из проблем коллоидной химии. Также к растворам поверхностно-активных веществ добавляют сульфокислоты, которые вместе используют для производства мыла, позволяют их применять в жесткой воде и даже кислой среде.
При введении в достаточно концентрированные растворы поверхностно-активных веществ практически нерастворимых в воде органических веществ (алифатических и ароматических углеводородов, малорастворимых красителей) последние способны коллоидно растворяться, при этом образуются почти прозрачные термодинамически равновесные растворы, что позволяет увеличивать время действия поверхностно-активных веществ на поверхность.
44. Поверхностное натяжение растворов ПАВ
Баланс молекулярных сил, а следовательно, и равновесное значение поверхностного натяжения устанавливаются практически мгновенно. Изотерма поверхностного натяжения, характеризующая зависимость этой величины от концентрации поверхностно-активного вещества, состоит из прямолинейного участка падения поверхностного натяжения, криволинейного участка, которое описывается уравнением Шишковского. На этом последнем участке поверхностное натяжение почти перестает изменяться, т. к. вновь вводимое поверхностно-активное вещество не адсорбируется на границе «раствор – воздух». Для поверхностно-активных веществ, не обладающих коллоидной растворимостью, участок на изотерме поверхностного натяжения сдвинут в область более высоких концентраций. На поверхности же растворов поверхностно-активных веществ должна установиться равновесная концентрация поверхностно-активного вещества, что осуществляется в результате процессов диффузии. Поэтому, если молекулы поверхностно-активного вещества большие, медленно диффундирующие, например молекулы из которых состоят высшие жирные кислоты и их соли, равновесное значение поверхностного натяжения на границе «раствор – воздух» может устанавливаться довольно долго. Тонкий слой на поверхности поверхностно-активного вещества при увеличении концентрации должен насыщаться. С ростом концентрации поверхностно-активного вещества число молекул в слое увеличивается, «хвосты» молекул приобретают вертикальное положение. Дальнейшее повышение концентрации поверхностно-активных веществ может привести к небольшому увеличению поверхностного натяжения и хорошей растворимости, из-за чего на границе раздела «жидкость – воздух» появляется небольшая часть этого вещества, которая попадает туда в результате диффузии из объема. При малых концентрациях поверхностно-активных веществ поверхностное натяжение раствора σ уменьшается прямо пропорционально концентрации с , т. е.
Δ = σ σ – σ = kc ,
где D – уменьшающееся поверхностное натяжение; σ σ – σ – поверхностные натяжения чистого раствора и растворителя; k – константа.
Но при сравнительно больших концентрациях снижение поверхностного натяжения во времени с возрастанием концентрации, описывается уравнением Шишковского , которое он предложил в 1908 г:
Δ = σ σ – σ = σ σ B ln(с / A + 1),
где В – const, равная 0,2 при температуре 20°,1/А – const, характерная для каждого поверхностно-активного вещества.
Это уравнение Шишковского хорошо применимо для вычисления поверхностного слоя жирных кислот, с числом атомов углерода не более восьми. И. Ленгмюр в 1917 г. использовал уравнение Шишковского в дифференцированном виде, что позволило перейти от уравнения Гиббса к уравнению Ленгмюра.
Σ σ – σ = σ σ В ln(с / A + 1) = σ σ B ln(с + А / А ) = σ σ B ln(с + А ) – σ σ B lnА .
Преобразовав это уравнение, получили:
– dσ / dc = Bσ σ / А + С .
Затем подставили это уравнение в уравнение Гиббса :
Г = Bσ σ / RT *С / А / 1 + С / А .
Обозначили величину Bσ σ /RT через α max , а 1 / А – через R , учли также тот факт, что при малых концентрациях Г практически равно α , и тогда записали что
α = α ma x kc / (1 + кс ),
где величина α – величина адсорбции, пропорциональная α .
45. Термодинамическое обоснование правила Траубе-Дюкло
Молекулы поверхностно-активных веществ обычно дифильны, в своем составе имеют полярную и неполярную части. Полярной частью поверхностно-активных веществ могут быть следующие группы:
– СООН, – OH, – NH 2 , -SH, – CN, – NO 2 , -NCS, – CHO, – SO 3 H.
Неполярной частью обычно являются алифатические или ароматические радикалы различного состава и строения (бензильный, фенильный). П. Э. Дюкло , а затем И. Траубе изучали поверхностное натяжение водных растворов представителей карбоновых жирных кислот и нашли закономерность, что поверхностная активность этих веществ на границе «раствор – газ» тем выше, чем больше длина углеводородного радикала, входящего в состав молекулы, причем поверхностная активность, как показали расчеты, увеличивается в 3,2 раза на каждую метиленовую группу. Можно сформулировать правило и по-другому, когда длина цепи жирной карбоновой кислоты возрастает в арифметической прогрессии, ее поверхностная активность увеличивается в геометрической прогрессии. Подобное же отношение должно соблюдаться при удлинении молекулы и для величины 1/А , поскольку поверхностная активность веществ при достаточно малых концентрациях пропорциональна удельной капиллярной постоянной. Смысл зависимости заключается в следующем: с увеличением длины цепи углеводорода уменьшается растворимость жирной кислоты, и тем самым молекулы ее стремятся перейти из объема в поверхностный слой жидкости. Пример : если масляная кислота смешивается с водой во всех отношениях, то уже валериановая кислота образует только 4 %-ный раствор, из этого следует, что кислоты с более высокими молекулярным весом все менее растворимы в воде. Работа для двух членов гомологического ряда равна:
A n – A n-1 = RT ln(Г / δ с ) т / (Г / δ с ) т-1 = КT ln3 = 640 ккал/моль,
где Г/δс – средняя концентрация в слое. Из этого уравнения видно, что работа адсорбции должна увеличиваться на постоянную величину при удлинении цепи на метиленовую группу. При небольших значениях концентраций, при которых только и соблюдается правило Дюкло-Траубе, все метиленовые группы занимают одинаковое положение по отношению к поверхности, что возможно лишь тогда, когда цепи расположены параллельно поверхности, т. е. лежат на ней. Правило Дюкло-Траубе выполняется при температурах, близких к комнатной, при более высоких температурах поверхностная активность снижается в результате десорбции молекул. Правило соблюдается для водных растворов поверхностно-активных веществ, для растворов поверхностно-активных веществ в неполярных растворителях данное правило действует в обратном направлении: с увеличением длины цепи растворимость поверхностно-активного вещества возрастает, и вещество стремится перейти из поверхностного слоя в раствор. Правило Дюкло-Траубе соблюдается не только для жирных кислот, но и для других гомологических рядов: спиртов (этилового C 2 H 5 OH), аминов (анилина PhNH 2). Правило Дюкло-Траубе позволило изучить влияние на адсорбцию строения и размера молекул поверхностно-активных веществ. Поверхностная активность определяется по уравнению Гиббса:
где ds / dc является поверхностной активностью.
Она берется из практически прямолинейного участка изотермы поверхностного натяжения. Когда концентрация растворенного вещества невелика и ее значение постоянно, она может служить мерой поверхностной активности исследуемого вещества.
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
4.1 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И АДСОРБЦИЯ
4.1.2 Адсорбция на границе раствор – пар
В жидких растворах поверхностное натяжение σ является функцией от концентрации растворенного вещества. На рис. 4.1 представлены три возможных зависимости поверхностного натяжения от концентрации раствора (т.н. изотермы поверхностного натяжения). Вещества, добавление которых к растворителю уменьшает поверхностное натяжение, называют поверхностно-активными (ПАВ), вещества, добавление которых увеличивает или не изменяет поверхностное натяжение – поверхностно-инактивными (ПИАВ).
Рис. 4.1
Изотермы поверхностного Рис. 4.2
Изотерма адсорбции
натяжения растворов ПИАВ (1, 2) и ПАВ на границе раствор – пар
ПАВ (3)
Уменьшение поверхностного натяжения и, следовательно, поверхностной энергии происходит в результате адсорбции ПАВ на поверхности раздела жидкость – пар, т.е. того, что концентрация поверхностно-активного вещества в поверхностном слое раствора оказывается больше, чем в глубине раствора.
Количественной мерой адсорбции на границе раствор-пар является поверхностный избыток Г (гамма), равный числу молей растворенного вещества в поверхностном слое. Количественное соотношение между адсорбцией (поверхностным избытком) растворенного вещества и изменением поверхностного натяжения раствора с ростом концентрации раствора определяет изотерма адсорбции Гиббса :
График изотермы адсорбции ПАВ представлен на рис. 4.2. Из уравнения (IV.5) следует, что направление процесса – концентрирование вещества в поверхностном слое или, наоборот, нахождение его в объеме жидкой фазы – определяется знаком производной d σ /dС. Отрицательная величина данной производной соответствует накоплению вещества в поверхностном слое (Г > 0), положительная – меньшей концентрации вещества в поверхностном слое по сравнению с его концентрацией в объеме раствора.
Величину g = –d σ /dС называют также поверхностной активностью растворенного вещества. Поверхностную активность ПАВ при некоторой концентрации С 1 определяют графически, проводя касательную к изотерме поверхностного натяжения в точке С = С 1 ; при этом поверхностная активность численно равна тангенсу угла наклона касательной к оси концентраций:
Нетрудно заметить, что с ростом концентрации поверхностная активность ПАВ уменьшается. Поэтому поверхностную активность вещества обычно определяют при бесконечно малой концентрации раствора; в этом случае её величина, обозначаемая g о, зависит только от природы ПАВ и растворителя. Исследуя поверхностное натяжение водных растворов органических веществ, Траубе и Дюкло установили для гомологических рядов поверхностно-активных веществ следующее эмпирическое правило:
В любом гомологическом ряду при малых концентрациях удлинение углеродной цепи на одну группу СН 2 увеличивает поверхностную активность в 3 – 3.5 раза.
Для водных растворов жирных кислот зависимость поверхностного натяжения от концентрации описывается эмпирическим уравнением Шишковского :
![]() (IV.6a)
(IV.6a)
Здесь b и K – эмпирические постоянные, причём значение b одинаково для всего гомологического ряда, а величина К увеличивается для каждого последующего члена ряда в 3 – 3,5 раза.

Рис. 4.3 Предельная ориентация молекул ПАВ в поверхностном слое
Молекулы большинства ПАВ обладают дифильным строением, т.е. содержат как полярную группу, так и неполярный углеводородный радикал. Расположение таких молекул в поверхностном слое энергетически наиболее выгодно при условии ориентации молекул полярной группой к полярной фазе (полярной жидкости), а неполярной – к неполярной фазе (газу или неполярной жидкости). При малой концентрации раствора тепловое движение нарушает ориентацию молекул ПАВ; при повышении концентрации происходит насыщение адсорбционного слоя и на поверхности раздела фаз образуется слой «вертикально» ориентированных молекул ПАВ (рис. 4.3). Образование такого мономолекулярного слоя соответствует минимальной величине поверхностного натяжения раствора ПАВ и максимальному значению адсорбции Г (рис. 4.1-4.2); при дальнейшем увеличении концентрации ПАВ в растворе поверхностное натяжение и адсорбция не изменяются.
Copyright © С. И. Левченков, 1996 — 2005.
Справочник химика 21
Химия и химическая технология
Дюкло Траубе, правило
Сформулируйте правило Дюкло - Траубе и поясните его физический смысл. При каком строении поверхностных пленок соблюдается это правило В чем заключается обратимость этого правила
Физический смысл правила Дюкло - Траубе
Коллоидные ПАВ проявляют высо.чую поверхностную активность, которая зависит, главным образом, от длины углеводородного радикала. Увеличение длины радикала на одну группу. -СН2- приводит к возрастанию поверхностной активности приблизительно в 3,2 раза (правило Дюкло - Траубе). Это правило соблюдается в основном для истинно растворимых ПАВ. Так как иоверхностную активность определяют нри бесконечном разбавлении системы, то легко объяснить ее зависимость от длины углеводородного радикала. Чем длиннее радикал, тем сильнее выталкивается молекула ПАВ из водного раствора (уменьшается раство-
Полученное выражение для соотношения г (п-Ы)/ Г (и) отражает правило Дюкло -Траубе.
Это правило выполняется лишь для водных растворов ПАВ. Для растворов ПАВ в неполярных растворителях поверхностная активность при увеличении длины углеводородного радикала, наоборот, уменьшается (обращение правила Дюкло - Траубе).
Все многообразие зависимостей поверхностного натяжения от концентрации может быть представлено кривыми трех типов (рис. 43). Для поверхностноактивных веществ (ПАВ) характерны кривые типа 1. ПАВ менее полярны по сравнению с растворителем, обладают меньшим, чем растворитель, поверхностным натяжением. Интенсивность взаимодействия молекул растворителя с молекулами ПАВ меньше, чем молекул растворителя между собой. По отношению к воде, полярному растворителю, поверхностно-активными веществами являются органические соединения, состоящие из углеводородного радикала (гидрофобная или олеофильная часть) и полярной группы (гидрофильная часть) карбоновые кислоты, их соли, спирты, амины. Такое дифильное строение молекулы является характерным признаком ПАВ. Углеводородные цепи, не имеющие постоянного дипольного момента, гидрофобны, взаимодействуют с молекулами воды слабее, чем между собой, и выталкиваются на поверхность. Поэтому органические вещества, не обладающие полярной группой (например, парафины, нафтены), в воде практически нерастворимы. Полярные группы типа -ОН, -СООН, -NH и др. обладают высоким сродством к воде, хорошо гидратируются, и наличие такой группы в молекуле обусловливает растворимость ПАВ. Таким образом, растворимость ПАВ в воде зависит от длины углеводородного радикала (растворимость уменьшается с увеличением длины в гомологическом ряду). Например, карбоновые кислоты i - С4 неограниченно растворяются в воде растворимость кислот С5 - С12 заметно падает с ростом числа С-атомов, а при длине углеводородной цепи более i2 они практически нерастворимы. Увеличение длины углеводородного радикала молекулы ПАВ на одну СНа-группу приводит к увеличению поверхностной активности в 3,2-3,5 раза (это правило называется правилом Дюкло - Траубе).
Ленгмюровские представления об адсорбции позволяют объяснить и известное правило Дюкло-Траубе (1878 г.), которое, так же как и уравнение Шишковского, было установлено экспериментально для растворов низших жирных кислот. Согласно этому правилу, отношение концентраций двух соседних гомологов, которым соответствуют одинаковые А, постоянно и приблизительно равно 3,2. К такому же выводу можно прийти, исходя из уравнения Шишковского. Для п-го и (п + 1)-го гомологов из (4.42) имеем
Уравнение (39) устанавливает зависимость поверхност-Бой активности от длины прямого насыщенного углеводородного радикала и, по существу, заключает в себе закономерность, известную как правило Дюкло - Траубе. Действительно, для (п+1)-го члена ряда можно записать
В соответствии с уравнением (42) значение коэффициента правила Дюкло - Траубе р зависит от величины инкремента ЛШ. Уменьшение этой величины приводит к снижению различия в поверхностной активности гомологов и наоборот.
Согласно Ленгмюру, правило Дюкло - Траубе можно обосновать следующим образом. Примем, что толщина поверхностного слоя равна O. Тогда средняя концентрация в этом слое будет Г/0. Из термодинамики известно, что максимальная работа А, требующаяся для сжатия газа от объема Fi до объема Vit может быть представлена как
Отношение (VI. 37) отражает правило Дюкло - Траубе. Оно является постоянной величиной и для водных растворов при 20°С составляет 3,2. При температурах, отличных от 20 °С, постоянная имеет другие значения. Поверхностная активность пропорциональна также константе, входящей в уравнение Ленгмюра (или уравнение Шишковского), так как Кг = КАоо (III. 17) и Лоо- емкость монослоя - постоянна для данного гомологического ряда. Для органических сред правило Дюкло - Траубе обращается поверхностная активность снижается с увеличением длины углеводородного радикала ПАВ.
Легко видеть, что уравнения (76) и (77) аналогичны уравнению (39), выражающему правило Дюкло - Траубе. Это указывает на связь объемных и поверхностных свойств растворов ПАВ и подчеркивает общность явлений адсорбции и мицеллообразования. Действительно, в гомологических рядах ПАВ величина ККМ изменяется примерно обратно пропорционально поверхностной активности, так что отношение ККМ соседних гомологов соответствует коэффициенту правила Дюкло - Траубе
Из этого уравнения видно, что работа адсорбции должна увеличиваться на постоянную величину при удлинении углеводородной цепи на группу СН2. Это значит, что при небольших концентрациях, при которых только и соблюдается правило Дюкло - Траубе, все группы СНа в цепи занимают одинаковое положение по отношению к поверхности, что возможно лишь, когда цепи расположены параллельно поверхности, т. е. лежат на ней. К вопросу об ориентации молекул поверхностно-активного вещества в поверхностном слое мы возвратимся ниже в этом разделе.
Т. е. G обратно пропорциональна Теперь правило Дюкло-Траубе запишется так
Правило Дюкло - Траубе так, как оно сформулировано выше, выполняется при температурах, близких к комнатной. При более высоких температурах отношение 3,2 уменьшается, стремясь к единице, так как с повышением температуры поверхностная активность снижается в результате десорбции молекул и различие между поверхностной активностью гомологов сглаживается.
Однако это объяснение противоречит тому факту, что измеренные на тех же самых объектах величины Гоо соответствуют стоячему, а не лежачему положению молекул, благодаря чему они почти не зависят от п. Чтобы устранить это противоречие, делается предположение, что при малом заполнении слоя, когда правило Дюкло-Траубе выполняется, адсорбированные молекулы лежат на поверхности, а при увеличении их плотности они постепенно поднимаются. Но очевидно, что такая трактовка несовместима со строгим применением ленгмюровской изотермы, в которой Гоо считается постоянной величиной, не зависящей от степени заполнения адсорбционного слоя.
Насколько соблюдается правило Дюкло - Траубе для гомологического ряда жирных кислот, можно видеть из данных табл. V, 4. Правило Дюкло - Траубе соблюдается не только для жирных кислот, но и для других гомологических рядов - спиртов, аминов и т. д.
Другая формулировка правила Дюкло - Траубе сводится к тому, что когда длина цепи жирной кислоты возрастает в арифметической прогрессии, поверхностная активность увеличивается в геометрической прогрессии. Подобное же отношение, должно соблюдаться при удлинении молекулы и для величины jA, поскольку поверхностная активность веществ при достаточно малых концентрациях пропорциональна удельной капиллярной постоянной.
Следует заметить также, что правило Дюкло - Траубе соблюдается лишь для водных растворов поверхностно-активных веществ. Для растворов этих же веществ в неполярных растворителях правило Дюкло - Траубе обращается, так как с увеличением
В первом приближении можно также принять, что чем лучше среда растворяет адсорбтив, тем хуже идет в этой среде адсорбция. Это положение является одной из причин обращения правила Дюкло - Траубе. Так, когда адсорбция жирной кислоты происходит на гидрофильном адсорбенте (например, силикагеле) из углеводородной среды (например, из бензола), адсорбция с увеличением молекулярного веса кислоты не возрастает, как это следовало бы из правила Дюкло - Траубе, а уменьшается, так как высшие жирные кислоты лучше растворимы в неполярной среде.
Понятно, что на непористых, с гладкими поверхностями адсорбентах такого обращения правила Дюкло - Траубе наблюдаться не может.
Правило Дюкло - Траубе
Правило Дюкло - Траубе для растворимых ПАВ выполняется в широком диапазоне концентраций, начиная от разбавленных растворов и кончая предельным насыщением поверхностных слоев. При этом коэффициент Траубе может быть выражен отношением концентраций, соответствующих насыщению поверхностного слоя
Правило Дюкло - Траубе имеет важное теоретическое и практическое значение. Оно указывает верное направление при синтезе высокоактивных ПАВ с длинными цепями.
Как формулируют правило Дюкло - Траубе Как его можно записать Как выглядят изотермы поверхностного натяжения двух соседних гомологов с числом атомов углерода п и п- —
Связь между константами, входящими в уравнение Шишковского, и строением молекул поверхностно-активных веществ можно установить, если обратиться к закономерности, установленной Дюкло и Траубе. Дюкло обнаружил, что способность поверхностно-активных веществ снижать поверхностное натяжение воды в гомологическом ряду усиливается с ростом числа углеродных атомов. Траубе дополнил наблюдения Дюкло. Найденная этими исследователями зависимость между поверхностной активностью и числом углеродных атомов получила название правила Дюкло - Траубе при увеличении числа углеродных атомов в гомологическом ряду в арифметической прогрессии поверхностная активность возрастает в геометрической прогрессии, причем увеличению углеводородной части молекулы на одну группу СНз соответствует возрастание поверхностной активности примерно в 3-3,5 раза (в среднем в 3,2 раза).
Правило Дюкло - Траубе наиболее точно выполняется при низких концентрациях растворенных веществ. Поэтому
Из правила Дюкло - Траубе следует важный вывод площадь, приходящаяся на одну молекулу при максимальном насыщении адсорбционного слоя, остается постоянной в пределах одного гомологического ряда.
Алифатические обратимые конкурентные ингибиторы. Как видно из рис. 37, сррбционный участок активного центра малоспецифичен по отношению к структуре алифатической цепи в молекуле ингибитора (алканолы). Независимо от того, является ли алифатическая цепь нормальной или разветвленной, эффективность обратимого связывания алканола КОН на активном центре определяется валовой гидрофобностью группы К. А именно, величина lg i, характеризующая прочность комплекса, возрастает линейно (с наклоном, близким к единице) со степенью распределения 1 Р этих соединений между водой и стандартной органической фазой (н-октанол). Наблюдаемая при этом величина инкремента свободной энергии переноса СНа-группы из воды в среду активного центра равна приблизительно -700 кал/моль (2,9 кДж/моль) (для низших членов гомологического ряда). Эта величина близка к значению инкремента свободной энергии, которое следует из известного в коллоидной химии правила Дюкло-Траубе и характерна для свободной энергии перехода жидкой СНа-группы из воды в неводную (гидрофобную) среду . Все это позволяет рассматривать гидрофобную область активного центра химотрипсина как каплю органического растворителя, расположенную в поверхностном слое белковой глобулы. Эта капля либо адсорбирует гидрофобный ингибитор из воды на поверхность раздела фаз, либо, будучи расположенной несколько углубленно, полностью экстрагирует его. С точки зрения микроскопической структуры гидрофобной области правильнее было бы рассматривать ее как фрагмент мицеллы, однако такая детализация представляется излишней, поскольку известно, что свободная энергия перехода н-алканов из воды в микроскопическую среду мицеллы додецилсульфата слабо отличается от свободной энергии выхода тех же соединений из воды в макроскопическую жидкую неполярную фазу ..
Адсорбция из органической фазы. В этом случае в соседнюю (водную) фазу переходит лишь полярная группа. Следовательно, работа адсорбции определяется только разностью энергии межмолекулярного взаимодействия полярных групп в органической фазе и воде, т. е. изменением их энергетического состояния при переходе из органической жидкости в воду. Поскольку углеводородные радикалы остаются в органической фазе, то пААУдаО и работа адсорбции из органической фазы равна Уо. В таком случае работа адсорбции не должна зависеть от длины углеводородного радикала и правило Дюкло - Траубе не должно соблюдаться. Действительно, как показывают экспериментальные данные, все нормальные спирты и кислоты примерно одинаково адсорбируются из парафиновых углеводородов на границе с водой. Это хорошо иллюстрирует рис. 4 . Величи-
Следовательно, поверхностная активность соединения тем больше, чем сильнее выражена полярная асимметрия молекулы. Влияние неполярной части молеку.1ы ПАВ на поверхностную активность проявляется наиболее чакономерно в гомологических рядах (рис. 20.1). Г. Дюкло обнаружил эту закономерность, которую затем П. Траубе более точно сформулировал в виде правила, получившего название правила Дюкло — Траубе
Величину р называют коэффициентом Траубе. Теоретическое объяснение правила Дюкло - Траубе было дано позже И. Ленгмю-ром. Он вычислил выигрыш энергии для двух соседних гомологов при переходе их углеводородных цепей из воды в воздух и нашел, что разность, соответствуюшая энергии перехода одной СНз-группы, постоянна в гомологических рядах и близка к, 3 кДж/моль. Выигрыш энергии обус ювлен тем, что при вытеснении неполярной цепи из водной среды в воздух диполи воды соединяются и энергия Гиббса системы уменьшается. Вместе с тем уменьшается энергия Гиббса и цепи ПАВ, перешедшей в среду, к которой имеет большое сродство по полярности.
Влияние длины цепи ПАВ. В гомологических рядах с увеличением молекулярной массы ПАВ величина ККМ уменьшается примерно обратно пропорционально поверхностной активности (ККМл 1/0м). Для соседних гомологов отношение ККМ имеет значение коэффициента правила Дюкло-Траубе (ККМ) /(ККМ) +1 Р = 3,2.
Ленгмюр показал, что правило Дюкло - Траубе мохкет быть использовано для расчета энергии переноса группы - Hj- из объема раствора в газовую фазу. Действительно, рассматривая Ь как константу адсорбционного равновесия [на с. 61 локазано, что для эквивалентной величины К справедливо K=kJ в соответствии с уравнением стандартной изотермы реакций имеем
Смотреть страницы где упоминается термин Дюкло Траубе, правило : Коллоидная химия 1982 (1982) — [ c.54 ]
Поверхностная активность. Поверхностно-активные и поверхностно-неактивные вещества. Правило Дюкло-Траубе.
Поверхностная активность
, способность вещества при адсорбции на границе раздела фаз понижать поверхностное натяжение (межфазное натяжение). Адсорбция Г
в-ва и вызванное ею понижение поверхностного натяжения s связаны с концентрацией с
в-ва в фазе, из которой вещество адсорбируется на межфазную поверхность, уравнением Гиббса (1876):  где R-
газовая постоянная, Т
-абс. температура (см. Адсорбция).
Производная
служит мерой способности вещества понижать поверхностное натяжение на данной межфазной границе и также наз. поверхностной активностью. Обозначается G (в честь Дж. Гиббса), измеряется в Дж м/моль (гиббсах).
где R-
газовая постоянная, Т
-абс. температура (см. Адсорбция).
Производная
служит мерой способности вещества понижать поверхностное натяжение на данной межфазной границе и также наз. поверхностной активностью. Обозначается G (в честь Дж. Гиббса), измеряется в Дж м/моль (гиббсах).
Поверхностно-активные вещества (ПАВ) , вещества, адсорбция которых из жидкости на поверхности раздела с другой фазой (жидкой, твердой или газообразной) приводит к значит. понижению поверхностного натяжения (см. Поверхностная активность). В наиболее общем и важном с практической точки зрения случае адсорбирующиесямолекулы (ионы) ПАВ имеют дифильное строение, т. е. состоят из полярной группы и неполярного углеводородного радикала (дифильные молекулы). Поверхностной активностью в отношении неполярной фазы (газ, углеводороднаяжидкость, неполярная поверхность твердого тела) обладает углеводородный радикал, который выталкивается из полярной среды. В водном растворе ПАВ на границе с воздухом образуется адсорбционный мономолекулярный слой с углеводородными радикалами, ориентированными в сторону воздуха. По мере его насыщения молекулы (ионы) ПАВ, уплотняясь в поверхностном слое, располагаются перпендикулярно поверхности (нормальная ориентация).
Концентрация ПАВ в адсорбционном слое на несколько порядков выше, чем в объеме жидкости, поэтому даже при ничтожно малом содержании в воде (0,01-0,1% по массе) ПАВ могут снижать поверхностное натяжение воды на границе с воздухом с 72,8 10 -3 до 25 10 -3 Дж/м 2 , т.е. практически до поверхностного натяжения углеводородныхжидкостей. Аналогичное явление имеет место на границе водный раствор ПАВ — углеводородная жидкость, что создает предпосылки для образования эмульсий.
В зависимости от состояния ПАВ в растворе условно различают истинно растворимые (молекулярно-диспергированные) и коллоидные ПАВ. Условность такого разделения состоит в том, что одно и то же ПАВ может относиться к обеим группам в зависимости от условий и хим. природы (полярности) растворителя. Обе группы ПАВ адсорбируются на фазовых границах, т. е. проявляют в растворах поверхностную активность, в то время как объемные свойства, связанные с возникновением коллоидной (мицеллярной) фазы, проявляют лишь коллоидные ПАВ. Указанные группы ПАВ отличаются значением безразмерной величины, которая наз. гидрофильно-липофильным балансом (ГЛБ) и определяется отношением:
Правило Дюкло-Траубе - зависимость, связывающая поверхностную активность водного раствора органического веществас длиной углеводородного радикала в составе его молекулы. Согласно этому правилу, при увеличении длины углеводородного радикала на одну группу СΗ 2 поверхностная активность вещества увеличивается в среднем в 3,2 раза .Поверхностная активность зависит от строения молекул ПАВ; последние обычно состоят из полярной части (группы, обладающие большим дипольным моментом) и неполярной части (алифатические или ароматические радикалы). В границахгомологического ряда органических веществ, концентрация, необходимая для понижения поверхностного натяжения водного раствора до определённого уровня, снижается в 3-3,5 раза при увеличения углеродного радикала на одну -СΗ 2 -группу.
Правило было сформулировано И. Траубе (нем.)русск. в 1891 году в результате его опытов, проведённых на растворах множества веществ (карбоновые кислоты, эфиры, спирты, кетоны) в воде. Предшествующие исследования Э. Дюкло хотя и были близки по духу к работам Траубе, но не предлагали никакой ясной зависимости концентрации, поэтому в зарубежной литературе правило носит лишь имя Траубе. . Термодинамическую интерпретацию правила Траубе дал в 1917 году И. Ленгмюр.
правило Дюкло-Траубе
Большой англо-русский и русско-английский словарь. 2001 .
правило Дюкло-Траубе - Правило Дюкло Траубе: с ростом длины углеродной цепи веществ одного гомологичного ряда адсорбция на неполярном адсорбенте из полярного растворителя возрастает примерно в 3 раза при увеличении углеводородной цепи на одну метиленовую группу CH2… … Химические термины
Правило Дюкло - Траубе зависимость, связывающая поверхностную активность водного раствора органического вещества с длиной углеводородного радикала в составе его молекулы. Согласно этому правилу, при увеличении длины углеводородного радикала на одну группу… … Википедия
Общая химия: учебник. А. В. Жолнин; под ред. В. А. Попкова, А. В. Жолнина. . 2012 .
Смотреть что такое «правило Дюкло-Траубе» в других словарях:
ПОВЕРХНОСТНОЕ ДАВЛЕНИЕ - (плоское давление, двумерное давление), сила, действующая на единицу длины границы раздела (барьера) чистой поверхности жидкости и поверхности той же жидкости, покрытой адсорбц. слоем поверхностно активного вещества. П. д. направлено в сторону… … Физическая энциклопедия
Медицина - I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
ИММУНИТЕТ - ИММУНИТЕТ. Содержание: История и современ. состояние учения об И. . 267 И. как явление приспособления. 283 И. местный. 285 И. к животным ядам. 289 И. при протозойн. и спирохета, инфекциях. 291 И. к… … Большая медицинская энциклопедия
Правило Траубе-Дюкло;
Как уже отмечалось, поверхностно-активные молекулы, способные адсорбироваться на поверхности раздела раствор–газ, должны быть дифильными, т.е. иметь полярную и неполярную части.
Дюкло, а затем Траубе, изучая поверхностное натяжение водных растворов гомологического ряда предельных жирных кислот, установили, что поверхностная активность (− ) этих веществ на границе раствор–воздух тем больше, чем больше длина углеводородного радикала, причем в среднем она увеличивается в 3–3,5 раза на каждую группу –СН 2 – . Эта важная закономерность получила название правила Траубе-Дюкло .
Правило Траубе— Дюклогласит:
в гомологическом ряду нормальных жирных одноосновных кислот поверхностная активность их (− ) по отношению к воде резко возрастает в 3–3,5 раза на каждую группу –СН 2 – при равной молярной концентрации.
Другая формулировка правила Траубе— Дюкло: “Когда длина цепи жирной кислоты возрастает в арифметической прогрессии, поверхностная активность увеличивается в геометрической прогрессии”. Правило Траубе— Дюкло хорошо иллюстрируется рисунком 18.1.
Как видно из рисунка, чем выше стоит вещество в гомологическом ряду, тем сильнее оно понижает поверхностное натяжение воды при данной концентрации.
Причина зависимости, установленной правилом Траубе— Дюкло, заключается в том, что с увеличением длины радикала уменьшается растворимость жирной кислоты и увеличивается стремление ее молекул перейти из объема в поверхностный слой. Установлено, что правило Траубе— Дюкло соблюдается не только для жирных кислот, но и для других гомологических рядов – спиртов, аминов и т.д.
Рис. 18.1 Правило Траубе— Дюкло:
1− уксусная кислота,2− пропионовая кислота,3− масляная кислота,4−валериановая кислота.
1) только при малых концентрациях, когда значение − – максимально;
2) для температур, близких к комнатной. При более высоких температурах множитель 3–3,5 уменьшается и стремится к единице. Увеличение температуры способствует десорбции молекул и поэтому поверхностная активность их уменьшается (различие между поверхностной активностью гомологов сглаживается);
3) только для водных растворов. ПАВ.
Американский физико-химик Ленгмюр установил, что правило Траубе справедливо лишь для малых концентраций ПАВ в растворе при свободном расположении адсорбированных молекул на поверхности (рис.18.6).
Рис. 18.6 Расположение адсорбированных молекул на границе раздела фаз:
а – при малых концентрациях; б – при средних концентрациях;
в – в насыщенном слое при максимально возможной адсорбции
ПРАВИЛО ДЮКЛО-ТРАУБЕ
Из уравнения Гиббса следует, что характеристикой поведения вещества при адсорбции является величина производной , однако ее значение изменяется при изменении концентрации (см. рис. 3.2). Чтобы придать этой величине вид характеристической постоянной, берут ее предельное значение (при с 0). Эту величину П. А. Ребиндер (1924) назвал поверхностной активностью g:
[g] = Дж– м 3 /м 2 -моль = Дж– м/моль или Н-м 2 /моль.
Чем в большей степени уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше поверхностная активность этого вещества, и тем больше его гиббсовская адсорбция.
Поверхностную активность можно определить графически как отрицательное значение тангенса угла наклона касательной, проведенной к кривой =f(c) в точке ее пересечения с осью ординат.
Таким образом, для ПАВ: g > 0; 0. Для ПИВ: g 0, Г i
Этим же объясняется инактивность сахарозы, молекула которой наряду с неполярным углеводородным каркасом имеет много полярных групп, поэтому в молекуле имеется баланс полярной и неполярной части.
2. В гомологическом ряду прослеживаются четкие закономерности в изменении поверхностной активности (g): она возрастает по мере увеличения длины углеводородного радикала.
1. Приготовьте 0,2, 0,1 0.05, 0,025 и 0,0125 М растворы трех спиртов (или органических кислот) одного гомологического ряда .
2. Определите величины их поверхностных натяжений с помощью прибора и метода Ребиндера, результаты и расчета запишите в таблицу 3.6
3. Постройте на одном графике изотермы поверхностного натяжения всех использованных вами растворов ПАВ одного гомологического ряда.
4. Из графика рассчитайте поверхностные активности Ds/DC всех растворов для всех концентраций из начальных линейных участков.
5. Рассчитайте отношение поверхностных активностей ближайших соседей гомологического ряда.
6. Сделайте вывод о выполнимости правила Дюкло – Траубе.
Таблица 3.6.
| Растворы | С, Моль/л | P =h 2 - h 1 | s, дн/см | Ds/DC |
| 0 | P o = | s o = | ||
| 0,0125 | ||||
| 0,025 | ||||
| 0,05 | ||||
| 0,1 | ||||
| 0,2 | ||||
| 0,0125 | ||||
| 0,025 | ||||
| 0,05 | ||||
| 0,1 | ||||
| 0,2 | ||||
| 0,0125 | ||||
| 0,025 | ||||
| 0,05 | ||||
| 0,1 | ||||
| 0,2 |
КОНТРОЛЬНЫЕ ВОПРОСЫ:
Перед выполнением работы:
1. Сформулируйте цель работы.
2. Расскажите порядок измерений для определения поверхностного натяжения методом Ребиндера.
3. Расскажите методику определения поверхностной активности растворов ПАВ и расчета адсорбции по Гиббсу.
4. Объясните порядок работы и расчетов по проверке выполнимости правила Дюкло – Траубе.
К защите работы:
1. Поверхностное натяжение – это …
2. Укажите факторы, влияющие на поверхностное натяжение жидкостей.
3. Есть ли различие в поверхностном натяжении мягкой и жесткой воды, образцы которой находятся при одинаковой температуре? Аргументируйте ответ.
4. Объясните различие терминов «абсорбция» и «адсорбция». Приведите примеры адсорбции и абсорбции.
5. Изобразите графики зависимости адсорбции от концентрации поверхностно – активного вещества при температурах Т 1 и Т 2 , учитывая, что Т 2 < Т 1.
6. Изобразите графики зависимости поверхностного натяжения от концентрации поверхностно – активного вещества при температурах Т 1 и Т 2 , учитывая, что Т 2 > Т 1.
7. Определите площадь, приходящуюся на одну молекулу анилина С 6 Н 5 NH 2 на границе его с воздухом, если предельная адсорбция анилина составляет Г ¥ = 6.0 10 –9 кмоль/м 2 .
8. Приведите пример процесса, в результате которого поверхностное натяжение воды становится равным нулю.
9. Из ряда представленных ниже соединений выберите такие, которые увеличивают поверхностное натяжение воды: NaOH, NH 4 OH, С 6 Н 5 NH 2 , СН 3 -СН 2 -СН 2 -СН 2 -СООН, СН 3 -СН 2 ОNa, KCNS
10. На сколько отличаются поверхностные активности этилового (СН 3 -СН 2 ОН) и бутилового (СН 3 -СН 2 -СН 2 -СН 2 ОН) спиртов одинаковой концентрации (при малых концентрациях).
11. Какое из перечисленных ниже соединений будет иметь наибольшую величину адсорбции при одинаковой концентрации: НСООН, СН 3 -СООН или СН 3 -СН 2 -СООН? Аргументируйте ответ.
ГАЗОВАЯ ХРОМАТОГРАФИЯ
Хроматографический метод разделения смеси веществ заключается в том, что вещества, составляющие смесь, движутся вместе с несорбирующимся газом-носителем вдоль поверхности сорбента (неподвижной фазы), и при этом непрерывно происходят процессы сорбции и десорбции этих веществ. Неподвижная фаза помещена в виде насадки в трубку, которая называется хроматографической колонкой через которую должны пройти все впущенные вещества, после чего на выходе из колонки они фиксируются хроматографическим детектором. Движение веществ вдоль колонки происходит только вместе с потоком газа-носителя, в то время, как в сорбированном состоянии они направленно не движутся. Поэтому чем больше среднее "время жизни" молекул индивидуального вещества в сорбированном состоянии, тем меньше их средняя скорость движения вдоль колонки. На рис.3.1 представлена хроматограмма, записанная детектором, для смеси из четырех веществ.
Рис. 4.1 Типичная хроматограмма смеси из четырех веществ.
Стрелкой на рис.4.1 обозначен момент впуска смеси в поток газа-носителя у входа в колонку. Общее время прохождения вещества через колонку (время удерживания ) t u складывается из времени движения с газом-носителем t 0 и суммарного времени нахождения в сорбированном состоянии t R (исправленное время удерживания ):
t u = t o + t R 4.1
t 0 одинаково для всех веществ, так как они перемещаются вдоль колонки вместе с газом-носителем с линейной скоростью его движения u 0 . Так как удерживание веществ в сорбированном состоянии происходит за счет взаимодействия молекул разделяемых веществ с молекулами жидкой пленки (распределительная хроматография) или поверхности твердой фазы (адсорбционная хроматография), то t R зависит от природы неподвижной фазы. Компоненты смеси, различающиеся по энергии взаимодействия с данной неподвижной фазой, будут иметь различные значения t R . Например, энергия указанных взаимодействий для производных углеводородов определяется длиной углеводородной цепи и наличием функциональных групп, следовательно, величина исправленного времени удерживания t R является качественной характеристикой данного вещества при постоянных условиях опыта: температуре и объемной скорости газа-носителя (w ).
Средняя линейная скорость движения i-го компонента смеси вдоль колонки u i = l/t u , где l - длина колонки, описывается основным уравнением:
 4.2
4.2
u 0 - скорость газа-носителя;
 - коэффициент Генри, т.е. коэффициент распределения i-го вещества между неподвижной и газовой фазами;
- коэффициент Генри, т.е. коэффициент распределения i-го вещества между неподвижной и газовой фазами;
С a и С - концентрации вещества в этих фазах при равновесии соответственно;
 называется отношением фаз и равняется отношению объёма V a неподвижной фазы, в котором происходит сорбция, к объёму подвижной (газовой) фазы в колонке V = wt o
., w – объемная скорость газа-носителя
.
называется отношением фаз и равняется отношению объёма V a неподвижной фазы, в котором происходит сорбция, к объёму подвижной (газовой) фазы в колонке V = wt o
., w – объемная скорость газа-носителя
.
В связи с тем, что Г i для различных веществ смеси отличаются друг от друга, движение их вдоль колонки происходит с разными средними скоростями, что и приводит к их разделению. Несорбирующиеся вещества, так же как и газ-носитель, проходят всю длину колонки за время t 0 . Таким образом,
 , 4.З
, 4.З
т.е.  , 4.4
, 4.4
Откуда
 , 4.5
, 4.5
Умножая правую и левую части на w , получаем
 , 4.6
, 4.6
V R - исправленный удерживаемый объём , зависит только от объёма неподвижной фазы в колонке и коэффициента Генри. Относительный удерживаемый объём двух компонентов 1 и 2, равный не зависит от V a , а только от природы веществ и температуры
 , 4.7
, 4.7
Таким образом, относительный удерживаемый объём является наиболее воспроизводимой качественной характеристикой вещества по сравнению с t u , t R и V R .
В составе его молекулы. Согласно этому правилу, при увеличении длины углеводородного радикала на одну группу СΗ 2 поверхностная активность вещества увеличивается в среднем в 3,2 раза .
Поверхностная активность зависит от строения молекул ПАВ ; последние обычно состоят из полярной части (группы, обладающие большим дипольным моментом) и неполярной части (алифатические или ароматические радикалы). В границах гомологического ряда органических веществ, концентрация, необходимая для понижения поверхностного натяжения водного раствора до определённого уровня, снижается в 3-3,5 раза при увеличения углеродного радикала на одну -СΗ 2 -группу.
Правило было сформулировано И. Траубе (нем.) русск. в 1891 году в результате его опытов, проведённых на растворах множества веществ (карбоновые кислоты, эфиры, спирты, кетоны) в воде. Предшествующие исследования Э. Дюкло хотя и были близки по духу к работам Траубе, но не предлагали никакой ясной зависимости концентрации, поэтому в зарубежной литературе правило носит лишь имя Траубе. . Термодинамическую интерпретацию правила Траубе дал в 1917 году И. Ленгмюр .
Wikimedia Foundation . 2010 .
Смотреть что такое "Правило Дюкло" в других словарях:
правило Дюкло-Траубе - Правило Дюкло Траубе: с ростом длины углеродной цепи веществ одного гомологичного ряда адсорбция на неполярном адсорбенте из полярного растворителя возрастает примерно в 3 раза при увеличении углеводородной цепи на одну метиленовую группу CH2… … Химические термины
- (плоское давление, двумерное давление), сила, действующая на единицу длины границы раздела (барьера) чистой поверхности жидкости и поверхности той же жидкости, покрытой адсорбц. слоем поверхностно активного вещества. П. д. направлено в сторону… … Физическая энциклопедия
- (France) Французская Республика (République Française). I. Общие сведения Ф. государство в Западной Европе. На С. территория Ф. омывается Северным морем, проливами Па де Кале и Ла Манш, на З. Бискайским заливом… … Большая советская энциклопедия
ИММУНИТЕТ - ИММУНИТЕТ. Содержание: История и современ. состояние учения об И. . 267 И. как явление приспособления........ 283 И. местный.................... 285 И. к животным ядам.............. 289 И. при протозойн. и спирохета, инфекциях. 291 И. к… …
- (France) гос во в Зап. Европе. Площ. 551 601 км2. Нас. 52 300 тыс. чел. (на 1 янв. 1974). Св. 90% населения французы. Столица г. Париж. Подавляющее большинство верующих католики. По конституции 1958 в состав Ф., кроме метрополии, входят:… …
Род. в Москве 3 апр. 1745 г., умер в С. Петербурге 1 дек. 1792 г. Родословные росписи рода Фонвизиных начинаются именем Петра Володимерова, титулуемого бароном. "В царство великого государя царя и великого князя Иоанна Васильевича, всея… … Большая биографическая энциклопедия
- (ФКП) осн. в дек. 1920 на съезде Французской социалистической партии (СФИО) в г. Туре революц. большинством этого съезда, решившим присоединиться к Коминтерну. В мае 1921 на административном съезде приняла назв. Французская коммунистич. партия. В … Советская историческая энциклопедия
- (от история (см.) и греч. grapo пишу, букв. описание истории) 1) История ист. науки, являющейся одной из важнейших форм самопознания человеческого общества. И. наз. также совокупность исследований, посвященных определенной теме или исторической… … Советская историческая энциклопедия
I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
ФЕРМЕНТЫ - (син. энзимы; франц. диастазы), биол. агенты, катализирующие большинство хим. реакций, лежащих в основе жизнедеятельности клетки и организма. Ряд характерных свойств термолябильность, специфичность действия, высокая каталитическая эффективность,… … Большая медицинская энциклопедия